آنالیز اسپرم- 3
تعیین میزان زنده بودن اسپرمها
معیار زنده بودن اسپرمها، سالم بودن غشاء آنها است. این آزمایش را میتوان بر روی همه نمونهها انجام داد، اما بیشتر در دو مورد زیر به کار میرود:
الف) وقتی تعداد اسپرمهای متحرک پیشرونده (PR) کمتر از 40% باشد.
ب) مشخص نمودن اینکه آیا در آزمایش اسپرموگرام درصد اسپرمهای متحرک و بیحرکت بیمار به درستی تعیین گردیده است یا خیر. اصولاً تعداد اسپرمهای بیحرکت بیمار نباید کمتر از اسپرمهای مرده باشد. اگر در آزمایش اسپرموگرام درصد اسپرمهای بیحرکت کمتر از درصد اسپرمهای مرده گزارش شده بود، مشخص میگردد که نتایج بهدست آمده غلط بوده و اسپرمهای بیحرکت کمتر از مقدار واقعی گزارش شدهاند.
برای تعیین درصد زنده بودن اسپرمها میتوان از دو روش رنگ پذیری و تورم در محلولهای هایپوتونیک استفاده نمود. اساس هر دو روش بر مبنای سالم بودن غشاء اسپرمهای زنده استوار است.
در روش رنگ پذیری از رنگهایی استفاده میشود که قادر به عبور از غشاء پلاسمایی اسپرمهای سالم نیستند. در اسپرمهایی که غشاء سلولی آسیب دیده دارند(اسپرمهای مرده)، رنگ وارد سلولها شده و اسپرماتوزوئیدها رنگی میشوند.
در روش دوم از محلولهای هایپوتونیک استفاده میشود. سلولهای زنده در محلولهای هایپوتونیک متورم میشوند در حالی که سلولهای مرده (که غشاء آسیبدیده دارند) فاقد این خاصیت میباشند.
ارزیابی زنده بودن اسپرم باید بلافاصله پس از سیال شدن نمونه (ترجیحاً پس از 30 دقیقه) انجام گردد.
نکته1: دانستن اینکه اسپرمهای بیحرکت زندهاند یا مرده از نظر بالینی اهمیت دارد و لذا ارزیابی میزان زنده بودن اسپرمهای نمونه به همراه نتایج تحرک اسپرم گزارش میگردد.
نکته 2: وجود اسپرمهای بیحرکت زنده به تعداد زیاد میتواند نشانگر اختلالات ساختمانی در فلاژل اسپرم باشد در حالیکه اگر اسپرمهای بیحرکت مرده(necrozoospermia) به تعداد زیاد وجود داشته باشند ممکن است نشانگر اختلالات اپیدیدیم باشد.
تعیین زنده بودن اسپرمها با استفاده از رنگ ائوزین ـ نیگروزین (Eosin-nigrosin):
استفاده از نیگروزین در این روش باعث میشود که کنتراست بین سرهای اسپرم و زمینه لام بیشتر شده و لذا اسپرمها را بهتر بتوان تشخیص داد. همچنین با این رنگآمیزی میتوان لامها را بایگانی نموده تا در صورت لزوم برای ارزیابی مجدد و کنترل کیفی مورد استفاده قرار گیرند.
آمادهسازی محلولها:
الف) محلول Eosin Y: مقدار 67/0 گرم از (Colour index 45380) Eosin Y و 9/0گرم کلرور سدیم (Nacl) را به کمک حرارت ملایم در 100 میلیلیتر آب مقطر حل میکنیم.
ب) محلول Eosin-nigrosin: مقدار 10 گرم نیگروزین (Colour index 50420) را به 100میلیلیتر از محلول ساخته شده فوق اضافه میکنیم.
ج) سوسپانسیون حاصل را جوشانده و اجازه میدهیم در حرارت اتاق سرد شود.
د) رنگ حاصل را از کاغذ صافی گذرانده تا رسوبات آن گرفته شود و آن را در ظروف شیشهای تیره و دربدار نگهداری میکنیم.
روش کار:
الف) نمونه را به خوبی مخلوط نموده و 50µL از آن را داخل لولهای ریختهای و همین مقدار رنگ ائوزین ـ نیگروزین به آن اضافه میکنیم و 30 ثانیه صبر میکنیم.
ب) نمونه را مجدداً مخلوط نموده و در یک لوله دیگر 50µL از نمونه را با همین مقدار رنگ مخلوط میکنیم.
ج) از هر یک از لولهها یک لام تهیه نموده و صبر میکنیم تا خشک شود و سپس با درشتنمایی 1000X آنها را بررسی میکنیم.
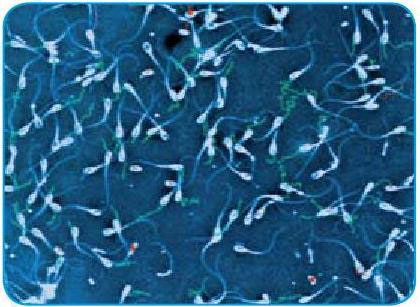
د) تعداد اسپرمهای رنگ گرفته (مرده) و رنگ نگرفته (زنده) را شمارش میکنیم. برای اینکه خطای کار کمتر باشد 200 اسپرم را در هر لام ارزیابی میکنیم. رنگ نیگروزین باعث میشود زمینه لام به رنگ سیاه درآمده و اسپرمها را بهتر بتوان دید. در این رنگآمیزی اسپرمهای زنده، سرهای سفید یا صورتی روشن و اسپرمهای مرده، سرهای قرمز یا صورتی پر رنگ دارند. اگر فقط ناحیه گردن اسپرم رنگ گرفته باشد و سر اسپرم بیرنگ باشد، اصطلاحاً به آن Leakyneck membraneگفته میشود. غشاء این سلولها کاملاً از بین نرفته و این اسپرمها را زنده در نظر میگیرند.
ﻫ) میانگین شمارش دو لام و اختلاف بین آنها را حساب نموده و به کمک جدول (1-2) آن را بررسی میکنیم. اگر میزان اختلاف شمارش در دو لام در محدودة قابل قبول بود میانگین نتایج را برای بیمار گزارش میکنیم و اگر بیش از حد مجاز بود آزمایش را از ابتدا تکرار میکنیم. برای گزارش نتایج، عدد حاصل را به نزدیکترین عدد صحیح گرد میکنیم.
لام رنگآمیزی شده با ائوزین نیگروزین. اسپرمهایی که سرهای قرمز رنگ یا صورتی تیره دارند به عنوان اسپرم مرده و اسپرمهایی که سرهای سفید یا صورتی روشن دارند به عنوان اسپرم زنده در نظر گرفته میشوند.
مقادیر مرجع : کمترین حد مرجع برای زنده بودن اسپرم 58% میباشد.
تعیین زنده بودن اسپرمها با استفاده محلول ائوزین:
در این روش نیگروزین وجود ندارد. روشی ساده و سریع است، اما لامها را نمیتوان نگهداری نمود.
آمادهسازی محلولها:
الف) کلرید سدیم 0/9%: مقدار 0/9 گرم کلرید سدیم را در 100 میلیلیتر آب مقطر حل کنید.
ب) محلول 0/5% Eosin: مقدار0/5 گرم ائوزین Y را در 100 میلیلیتر از محلول کلریدسديم 9 /0% حل نمائید
روش کار:
الف) نمونه را به خوبی مخلوط نموده و 5µL از آن را روی یک لام گذاشته و به آن 5µL محلول ائوزین اضافه میکنیم. با نوک سمپلر آنها را مخلوط نموده و روی لام پخش میکنیم. سپس یک لامل 22×22 روی آن گذاشته و 30 ثانیه صبر مینماییم.
ب) نمونه را مجدداً مخلوط نموده و یک لام دیگر به روش ذکر شده تهیه مینماییم.
ج) لامها را با بزرگنمایی 200 یا 400 و ترجیحاً با میکروسکوپ فاز کنتراست منفی بررسی میکنیم (اگر میکروسکوپ فاز کنتراست مثبت استفاده شود، اسپرمهایی که صورتی کمرنگ شدهاند به سختی تشخیص داده میشوند).
د) تعداد اسپرمهای رنگ گرفته (مرده) و رنگ نگرفته (زنده) را شمارش میکنیم و برای اینکه خطای کار کمتر باشد 200 اسپرم را در هر لام ارزیابی مینماییم. اسپرمهای زنده سرهای سفید یا صورتی روشن داشته و اسپرمهای مرده سرهای قرمز یا صورتی پر رنگ دارند. اگر فقط ناحیه گردن اسپرم رنگ گرفته باشد و سر اسپرم بیرنگ باشد اصطلاحاً به آن Leaky neck membrane گفته میشود و همانطور که قبلاً هم ذکر شد این اسپرمها را زنده در نظر میگیریم. اگر تشخیص اسپرمهایی که صورتی روشن هستند مشکل باشد، باید از نیگروزین کمک گرفت تا با افزایش کنتراست زمینه لام، تشخیص آنها را تسهیل نماید.
ﻫ) میانگین شمارش دو لام و اختلاف بین آنها را حساب نموده و به کمک جدول آن را بررسی میکنیم. اگر میزان اختلاف شمارش در دو لام در محدودة قابل قبول بود میانگین نتایج را برای بیمار گزارش میکنیم و اگر بیش از حد مجاز بود آزمایش را از ابتدا تکرار میکنیم. برای گزارش نتایج، عدد حاصل را به نزدیکترین عدد صحیح گرد میکنیم.
مقادیرمرجع : کمترین حد مرجع برای زنده بودن اسپرم 58% است.
نکته: تعداد کل اسپرمهای مایع منی که غشاء سلولی سالم دارند، دارای اهمیت بیولوژیک است. برای محاسبه آنها تعداد کل اسپرمها را در درصد اسپرمهای زنده ضرب میکنیم.
تعیین زنده بودن اسپرمها با استفاده از محلولهای هایپوتونیک (Hos):
این روش در دو مورد زیر به کارمیرود:
الف) تعیین زنده بودن اسپرمها
ب) در روش ICSI (تزریق اسپرم به داخل سیتوپلاسم تخمک) برای جداسازی اسپرمها میتوان استفاده نمود.
اسپرمهایی که غشاء سلولی سالم داشته باشند، طی 5 دقیقه در محیط هایپوتونیک متورم شده و پس از نیم ساعت این تورم فیکس شده و غیر قابل برگشت خواهد بود. اگر بخواهیم از این روش برای شناسایی اسپرمهای زنده استفاده نماییم زمان انکوباسیون در محلولهای هایپوتونیک 30 دقیقه است، ولی در صورتی که بخواهیم آنها را برای روش ICSI جدا نماییم این زمان 5 دقیقه خواهد بود.
آمادهسازی محلولها:
محلول هایپوتونیک: مقدار 0/735 گرم سیترات سدیم دو آبه (Na3C6H5O7, 2H2o) و 1/351 گرم D فروکتور را در 100 میلیلیتر آب مقطر حل مینماییم. محلول فوق را در حجمهای 1 میلیلیتر داخل لولههای متعدد ریخته و در دمای -20°C فریز مینماییم.
نکته :در روش ICSI محلول فوق را به نسبت یک به یک با آب مقطر استریل رقیق میکنیم.
روش کار:
الف) محلول هایپوتونیک را از فریز خارج نموده و به خوبی مخلوط میکنیم. سپس 5 دقیقه در 37°C قرار داده تا گرم شود.
ب) نمونه را به خوبی مخلوط نموده 100µL از آن را به لوله حاوی محلول هایپوتونیک اضافه میکنیم. نمونه را به کمک سمپلر چند بار داخل لوله کشیده و خالی میکنیم تا مخلوط شود.
ج) لوله را 30 دقیقه (و یا 5 دقیقه در روش ICSI) در37°C قرار داده و سپس 10µL از آن را روی یک لام گذاشته و با لامل 22×22 میپوشانیم.
د) نمونه را مجدداً مخلوط نموده و به روش فوقالذکر 100µL از آن را با محلول هایپوتونیک مخلوط کرده و لام دیگری تهیه میکنیم.
ﻫ) لامها را با بزرگنمایی 200 یا 400 و میکروسکوپ فاز کنتراست بررسی میکنیم. در هر لام تعداد 200 اسپرم را ارزیابی نموده و اسپرمهای مرده و زنده را میشماریم. مطابق شکل حلقه شدن دم اسپرمها نشانه متورم شدن آنهاست که به نوبه خود نشانگر زنده بودن اسپرم است. تورم به هر شکلی که باشد، نشانه زنده بودن اسپرم است. میانگین شمارش دو لام و اختلاف بین آنها را حساب نموده و آن را بررسی میکنیم. اگر میزان اختلاف شمارش در دو لام در محدوده قابل قبولی بود، میانگین نتایج را گزارش میکنیم و در غیر این صورت آزمایش را تکرار میکنیم.
مقادیر مرجع: کمترین حد مرجع برای اسپرمهای زنده با این روش نیز 58% میباشد.
شمارش اسپرم
غلظت اسپرم و تعداد کل اسپرمهای مایع منی با بروز حاملگی مرتبط میباشند. در مردان سالم که انسدادی در دستگاه تناسلی نداشته و زمان زیادی از آخرین مقاربت آنها نگذشته باشد، تعداد کل اسپرمها با حجم بیضهها متناسب بوده و لذا معیار توانایی بیضهها در تولید اسپرم است، اما غلظت اسپرم چون تحتتأثیر حجم ترشحات وزیکولهای سمینال و پروستات است، لذا نمیتواند معیاری اختصاصی برای ارزیابی عملکرد بیضهها محسوب گردد.
نکته1: اصطلاح غلظت اسپرم با تعداد کل اسپرمها معنای یکسانی ندارد. غلظت اسپرم به تعداد اسپرم در واحد حجم اطلاق میشود (پس علاوه بر تعداد اسپرمهای خارج شده از فرد، تحت تأثیر ترشحات رقیقکننده آن نیز قرار دارد)، در حالیکه تعداد کل اسپرم بیانگر کل اسپرمهایی است که در مایع انزالی وجود دارد و از حاصل ضرب غلظت اسپرم در حجم مایع انزالی به دست میآید.
نکته2: بیان این مطلب که تعداد کل اسپرمها نشانه میزان فعالیت بیضهها در تولید اسپرم است، در برخی موارد صدق نمیکند. از جمله این موارد عبارتند از:
– کسانی که آسیبهای نخاعی دیدهاند وelectro-ejaculation روی آنها انجام میشود.
– افرادی که کمبود آندروژن دارند.
– افرادی که انزال رتروگراد نسبی دارند.
– کسانی که به مدت طولانی مقاربت نداشته اند.
نکته 3: اصطلاح دانسیته اسپرم (جرم در واحد حجم) نباید به جای غلظت اسپرم (تعداد در واحد حجم) به کار رود.
در شمارش اسپرم ابتدا یک لام مستقیم از نمونه تهیه کرده و با مشاهده اسپرمها، رقت لازم برای شمارش آنها را تخمین میزنیم. سپس به کمک لام هماسيتومتراسپرمها را شمارش کرده و غلظت آنها را به دست میآوریم. لامهای هماسيتومتر انواع مختلفی دارند. توصیه میشود از لامهایی استفاده نماییم که عمق 100µmدارند. لامهای یکبار مصرف نیز برای شمارش اسپرم وجود دارند، اما نتایج آنها ممکن است قابل اعتماد نباشد. بهترین روش، استفاده از لام اصلاح شده نئوبار است. در این لام دو قسمت برای شمارش وجود دارد. در هر قسمت یک مربع بزرگ 3×3 mm روی لام حک شده و این مربع بزرگ به 9 مربع کوچکتر 1×1mmتقسیم شده است . لام نئوبار را با لامل مخصوصی میپوشانند که وقتی روی لام گذاشته میشود عمقی برابر 0.1 mm ایجاد میکند.
بر اساس اینکه برای شمارش اسپرم از چه رقّتی استفاده شود از مربعهای مختلف در شمارش اسپرم استفاده میکنیم، مثلاً اگر مایع منی را 1:20 یا 1:5 رقیق نماییم از مربع شماره 5 (و در موارد لزوم از مربعهای 6 و 4) استفاده میشود، در حالی که اگر مایع منی 1:2 رقیق شود همه مربعها (1 تا 9) در شمارش منظور میگردند. در هنگام شمارش فقط اسپرمهایی شمارش میشوند که دارای سر و دم هستند(اسپرم کامل) . مرز هر کدام از مربعهای 9گانه دارای سه خط میباشد. در صورتی که سر اسپرم داخل مربع یا روی دو خط داخلی حاشیه آن باشد آن اسپرم را در شمارش منظور مینمائیم، اما اگر سر اسپرم، بیشتر روی دو خط خارجی باشد در شمارش محسوب نمیگردد. در هنگام شمارش محل قرار گرفتن دم اسپرم اهمیتی نداشته و فقط سر آن را در نظر میگیریم. برای اینکه اسپرمهای روی خطوط دو بار شمارش نشوند، در هر مربع فقط دو ضلع را در نظر میگیریم (مثلاً بالا و راست یا پایین و چپ) پس از اینکه کار شمارش تمام شد، لام و لامل را با آب شسته و با یک پارچه نرم خشک مینماییم زیرا استفاده از پارچههای زبر باعث خش افتادن لام میشود. بهتر است لام و لامل را پس از مصرف، یک شب در محلول ضد عفونیکننده قرار داده تا از انتقال عوامل پاتوژن خطرناک که ممکن است در اسپرم وجود داشته باشد جلوگیری نماییم.
فیکس کردن اسپرمها برای شمارش
برای شمارش باید اسپرمها را فیکس نمود، زیرا در صورتی که حرکت داشته باشند دائماً از مربعها خارج شده یا وارد آن میشوند و باعث خطا در شمارش میگردند. برای این کار 50g بیکربنات سدیم (NaHCo3)، 10mL فرمالین 35% (V/V) را در 1000mL آب مقطر حل میکنیـــــم. در صورت لزوم میتوان 0.25g از trypan blue (کد رنگ 23859) و یا 5ml محلول اشباع (>4 mg/ml)Gentian Violet (کد رنگ 42555) به محلول فیکسکننده فوق افزوده تا اسپرمها بهتر دیده شوند. این محلول را در 4°c نگهداری میکنیم و در صورت ایجاد رسوب قبل از مصرف آن را صاف میکنیم.
توجه: برای اینکه خطای ناشی از برداشتن نمونه را کم کنیم لازم است تا نمونه را دو بار شمارش نماییم و در هر بار شمارش 200 اسپرم ارزیابی گردد. اگر تعداد کمی اسپرم شمرده شود جوابها قابلاعتماد نخواهد بود. وقتی تعداد اسپرم بیمار خیلی کم باشد، نمیتوان در هر بار 200 اسپرم را شمارش نمود.

سلام منابع مطلب رو میگید لطفا
مطالب از منابع معتبر استخراج می شوند.