مروری بر اپيدميولوژی عفونتهای قارچی
دكتر محمد قهری – آزمایشگاه رسالت
مقدمه
در قارچشناسی پزشكی مدرن عفونتهای قارچی را به دو دسته بزرگ طبقهبندی میكنند: عفونتهای بیمارستانی که عمدتاً توسط قارچهای فرصتطلب و ساپروپ در افراد دارای زمینههای خطر ایجاد میشوند و عفونتهای مکتسبه از طریق جامعه که شامل بیماریهای قارچی اندمیک نیز میباشند. در بخش نخست عفونتهای ناشی از كاندیدا و آسپرژیلوس بطور اختصار مورد بحث قرار گرفتند. در این قسمت زایگومیستها، پاتوژنهای قارچی جدید (عمدتاً از دستهی مخمرها)، قارچهای دوشكلی یا آندمیك و بالاخره قارچهای فرصتطلب مرور میشوند.
زایگومیستها
زایگومایكوزیس یك واژه عمومی است كه دربرگیرنده عفونتهایی میشود كه بوسیله قارچهای دسته موكورالها و انتموفتورالها (رده زیگومیستها) پدید میآید، گرچه رایزوپوس آریزوس شایعترین عامل زایگومایكوزیس انسانی است. گونههای دیگر رایزوپوس، رایزوموكور، آبسیدیا و كانینگهاملا نیز عفونتهای تهاجمی در بیماران بستری شده در بیمارستان ایجاد مینمایند. زایگومیستها در همه جای جهان، در خاك و گیاهان در حال فساد وجود دارند و عفونت ممكن است بوسیله استنشاق، بلعیدن یا آلوده شدن زخمها با كنیدیهای موجود در محیط پدید آید. همانند گونههای آسپرجیلوس، انتقال عفونت بیمارستانی ناشی از زایگومیستها میتواند بوسیله سیستمهای تهویه هوا بویژه در جریان ساختمانسازی و تعمیرات ساختمانی بیمارستان واقع شود.همهگیریهای كانونی (Focal) زایگومیكوزیس نیز به استفاده از بانداژهای چسبنده یا نوار چسب بر روی زخمهای باز كه منجر به عفونت اولیه پوستی میشود مربوط شده است. زایگومیكوزیس تهاجمی در بیماران دارای اختلال در سیستم ایمنی پدید میآید و از نظر كلینیكی بسیار شبیه به آسپرجیلوزیس تهاجمی است. تخمین زده شده است كه زایگومیستها میتوانند در 1 تا 9 درصد دریافتكنندگان پیوند عضو عفونت ایجاد نمایند، بویژه در آنهایی كه بطور زمینهای مبتلا به دیابت ملیتوس هستند. فاكتورهای خطر شامل درمان با كورتیكوستروئید و دفروكسامین، كتواسیدوز دیابتی، نارسایی كلیه، بدخیمیهای هماتولوژیك، سركوبی مغز استخوان و مواجهه با فعالیتهای عمرانی بیمارستان است.
پاتوژنهای قارچی جدید ایجاد كننده عفونت بیمارستانی
تعداد گونههای قارچی امروزه افزون بر 100/000 نوع تخمین زده میشود و در هر سال تقریباً 1500 گونه جدید به این لیست افزوده میشود. از آنجا كه تعداد افراد دارای اختلالات سیستم ایمنی در سطح جهان رو به افزایش است، به وضوح میتوان گفت كه اگر نه همه آنها، ولی بسیاری از این قارچها قادر به ایجاد عفونت انسانی هستند. از طرف دیگر با توجه به اینكه آگاهی ما نیز از عفونتهای قارچی در حال افزایش است، با این حال بنابر گفته Ajello ما صرفاً قله كوه یخ قارچشناسی پزشكی را مشاهده میكنیم. با در نظر گرفتن وضعیت ایمنولوژیك بیماران بستری در بیمارستان میتوان گفت: هیچ قارچ غیرپاتوژنی وجود ندارد.
اكثر عفونتهای قارچی بیمارستانی بوسیله گونههای مختلف كاندیدا و آسپرجیلوس ایجاد میشوند. تعداد قابلتوجهی از عفونتها امروزه توسط طیف وسیعی از قارچها تحتعنوان پاتوژنهای قارچی جدید پدید میآیند. این ارگانیسمها شامل مخمرهایی غیر از گونههای كاندیدا، كپكهای شفاف (هیالین) و غیررنگی و قارچهای پیگماندار یا دیماتیاسئوس هستند. عفونتهایی كه بوسیله این قارچها ایجاد میشوند از فونژمیهای مرتبط با كاتتر و پریتونیت تا عفونتهای منتشره از طریق جریان گردش خون تا عفونتهای لوكالیزه كه ریه، پوست و سینوسهای اطراف بینی را درگیر میكند متفاوت است. با توجه به این كه تعداد عفونتهای مربوط به هر یك از این پاتوژنهای جدید كم است، فهم و درك ما از اپیدمیولوژی و روشهای درمان برای این دسته از عفونتهای اختصاصی در حداقل میزان خود میباشد. در بین مخمرهای غیر از جنس كاندیدا، عفونتهای بیمارستانی مربوط به مالاسزیا، تریكوسپورون، رودوترولا و ساكارومیسس سرویسیه برجستهتر از بقیه است.
عفونتهای مربوط به مالاسزیا
عفونتهای مربوط به مالاسزیا (مالاسزیا فورفور و مالاسزیا پاكیدرماتیس) معمولاً مربوط به كاتتر هستند و بیشتر در اطفال نارس دیده میشوند. در بین گونههای مالاسزیا، مالاسزیا فورفور بدلیل نیازمندیاش برای رشد به لیپید خارجی قابلتوجه است. این نیاز رشدی تا حدودی اپیدمیولوژی مالاسزیا فورفور را توضیح میدهد، زیرا عفونتهای بیمارستانی مربوط به این ارگانیسم در بیشتر موارد مربوط به استفاده از مكملهای لیپید داخل وریدی از طریق یك كاتتر مركزی است. هرچند كه مالاسزیا پاكیدرماتیس برای رشد نیاز به منابع لیپید خارجی ندارد اما اسیدهای چرب رشد این ارگانیسم را تحریك میكنند و عفونتهای مربوط به این ارگانیسم با تغذیه غیردهانی و استفاده داخل رگی از لیپید مرتبط بوده است. اكثر عفونتهای مربوط به مالاسزیا بطور اسپورادیك دیده میشوند. اگرچه اپیدمیها یا طغیانهای فونژمی در واحدهای مراقبت ویژه نوزادان مشاهده شده است و مطالعات ملكولی امكان انتقال فرد به فرد بوسیله تماس دستی پزشكان و پرستاران را مطرح كرده است.
تریكوسپورونوزیس
تریكوسپورونوزیس عفونتی مربوط به تریكوسپورون بیژلی (تریكوسپورون كوتانئوم) است. این ارگانیسم به صورت متداول از مو و پوست جدا میشود. تریكوسپورون بیژلی امروزه بعنوان یك عامل مهم عفونتهای عمقی (عامل عفونت خون، پریتونیت و اندوكاردیت) در بیماران بستری در بیمارستان شناخته شده است. تریكوسپورونوزیس بیمارستانی اغلب بوسیله فونژمی تشخیص داده میشود و این كار معمولاً بوسیله كشت خون مسجل میگردد. اگرچه اكثر عفونتها اسپورادیك هستند اما یك گروه از عفونتهای تهاجمی در بخش مراقبت ویژه نوزادان گزارش شده است. فقدان نسبی حساسیت به آمفوتریسین B در تریكوسپورون بیژلی و همچنین نسبت به عوامل ضدقارچی دیگر، علت دیگری در توجه به تریكوسپورونوزیس بیمارستانی است.
رودوترولا و ساكارومایسس
عفونتهای بیمارستانی مربوط به گونههای رودوترولا و ساكارومایسس سرویسیه نادر، ولی با اهمیت هستند زیرا این قارچها به عوامل ضد قارچی آزولی معمول حساسیت ندارند. رودوترولا روبرا میتواند در پوست، ادرار و مدفوع كلونیزه شود و در عفونتهای منتشره، اندوكاردیت، مننژیت و پریتونیت در بیمارانی كه بصورت سرپایی دیالیز پریتونال میشوند، دیده شده است. فونژمی مربوط به این ارگانیسم میتواند مربوط به كلونیزاسیون یا آلودگی كاتترها و دیگر وسایل رگی باشد. مواجهه با ساكارومایسس سرویسیه در همهجا وجود دارد و اكثر اوقات از طریق غذا اتفاق میافتد. ساكارومایسس سرویسیه میتواند بخشی از فلور نرمال دستگاه گوارشی را تشكیل دهد و در دهان و حلق و واژن وجود داشته باشد. مدارك و شواهد رو به افزایش وجود دارد كه نشان میدهد ساكارومایسس سرویسیه عامل بیماری تهاجمی بوده است. در بیماران ایدزی، گیرندگان پیوند و بیماران ناتوان دارای بدخیمیها، ساكارومایسس سرویسیه از خون و نواحی استریل دیگر بدن جدا شده و با بیماری كلینیكی شدید همراه بوده است. مطالعات اپیدمیولوژی ملكولی نشان داده است كه اگر چه اكثر بیماران با یك استرین واحد ساكارومایسس سرویسیه مربوط به خودشان كلونیزه شده ویا عفونت داشتند، گروههایی از ایزولههای یكسان در بین بیماران مختلفی كه همزمان در یك بخش بستری شده بودند شناسایی شد كه نشاندهنده امكان انتقال عفونت بیمارستانی است.
هایفومیستهای شفاف
هایفومیستهای شفاف، طیفی از پاتوژنهای قارچی فراگیر (در همهجا موجود) محیطی را شامل میشوند. بیش از 20 جنس مختلف بعنوان عوامل مسبب هیالوهایفومیكوز شناخته شدهاند كه شامل پاتوژنهای فرصتطلب متنوعی مانند آكرومونیم، كرایزوسپوریوم، فوزاریوم، پسیلومایسس، پنیسیلیوم، اسكوپولاریوپسیس و سپدونیوم میباشند. اگرچه عفونتهای ناشی از اكثر این قارچها نسبتاً ناشایع هستند، اما به نظر میرسد كه میزان بروز آنها در حال افزایش است. تصور میشود كه اكثر عفونتهای گسترده (منتشره) از طریق استنشاق كنیدیها یا بوسیله پیشروی لزیونهای پوستی لوكالیزه قبلی پدید آمده باشند. مهمترین این عوامل بعنوان عامل عفونت قارچی بیمارستانی فوزاریوم است. گونههای فوزاریوم با افزایش موارد بروز بعنوان عوامل عفونتهای بیمارستانی در بیمارانی كه سیستم ایمنی سركوب شدهای دارند، شناخته شدهاند. بیماران مبتلا به بدخیمیهای خونی كه شیمیدرمانی میشوند، گیرندگان پیوند مغز استخوان و بیمارانی كه دچار سوختگیهای وسیع شدهاند در معرض خطر زیادی برای فوزاریوز پیشرونده و مهاجم میباشند. گونههای فوزاریوم دومین عامل شایع عفونتهای قارچی غیركاندیدایی بعد از پیوند مغزاستخوان در دانشگاه مینسوتا بوده است و علت 7% موارد پریتونیت در افراد غیربستری كه به صورت مستمر دیالیز پریتوانی میشدهاند بوده است. این ارگانیسم در همهجا در محیط وجود دارد و مكانیزم عفونت میتواند شامل استنشاق بداخل ریهها یا راههای هوایی فوقانی (سینوسهای پارانازال، آلوده شدن كاتترهای پریتوان یا آسیبهای پوست و غشاءهای مخاطی باشد. در بین بیماران نوتروپنیك، عفونت نسج اطراف ناخن لوكالیزه شده در انگشتان پا غالباً منجر به انتشار خونی میشود. اگرچه كشتهای خون تقریباً همیشه در عفونتهای مهاجم مربوط به آسپرجیلوس منفی هستند، تقریباً 75% بیماران مبتلا به فوزاریوز دارای كشت خون مثبت میباشند، اما متأسفانه پیامد فوزاریوز منتشره بسیار بد است و تقریباً تمام بیماران فوت میكنند.
فئوهایفومیكوز
فئوهایفومیكوز عفونتی است كه بوسیله مخمرها یا كپكهای پیگماندار یا دیماتیاسئوس ایجاد میشود. عفونتهای مربوط به قارچهای دیماتیاسئوس یك گروه با اهمیت و به لحاظ شیوع رو به افزایش در بین بیماریهای قارچی فرصتطلب است و میتواند بصورت بیماری منتشره دیده شود و یا اینكه در ریهها، سینوسهای پارانازال یا سیستم عصبی مركزی بصورت لوكالیزه درآید. قارچهای دیماتیاسئوس مسبب عفونت در انسان شامل تعداد زیادی از گونههای مختلف آن میباشد. البته اكثر عفونتها توسط آلترناریا، بایپولاریس، كوروولاریا، كلادوسپوریوم و اگزروهیلوم ایجاد میشوند.
گونههای آلترناریا شایعترین قارچ دیماتیاسئوس، مسبب عفونت در گیرندگان پیوند مغز استخوان در دانشگاه مینسوتا بوده است و بیماری سینوسهای اطراف بینی در بیماران نوتروپنیك و نیز در بیماران ایدزی بصورت پیشرونده ایجاد كرده است. مخزن و منبع این ارگانیسمها محیط میباشد و انتقال میتواند بوسیله استنشاق یا تلقیح ابتدایی داخل جلدی صورت گیرد.
اپیدمیولوژی ملكولی: مخازن و روشهای انتقال
در مطالعات نوین اپیدمیولوژیك، امروزه نیازمند آن هستیم كه پاتوژنهای بیمارستانی درسطح زیرگونه شناسایی و مشخص شوند تا امكان اینكه پروسههای عفونی و شیوههای انتقال بهتر مشخص و معین شوند، فراهم آید. گرچه بسیاری از روشهای فیزیولوژیك و یا روشهای تایپینگ مبتنی بر پروتئین در بررسیهای اپیدمیولوژیكی مورد استفاده قرارگرفته است، روشهای ملكولی بر اساس DNA (انگشتنگاری DNA) برای این منظور بسیار مفید بوده است. سیستمهای ملكولارتایپینگ برای كمك به میكروبیولوژیست، كلینیسین و اپیدمیولوژیست برای پاسخ دادن به این سئوال كه 2 ایزوله یا بیشتر از یك گونه قارچ آیا در واقع یكی هستند و یا متفاوت میباشند، استفاده گردیده است. این سئوال ممكن است از تحقیقات و جستجوهای اپیدمیولوژیكی برخاسته باشد. انواع مختلفی از روشهای تایپینگ انگشتنگاری ملكولار برای قارچهای متفاوت است و روشی كه در یك مطالعه خاص بكار رفته است ممكن است برحسب ارگانیسم و هدف اختصاصی آن مطالعه فرق داشته باشد. در یك تحقیق اپیدمیولوژیكی، جدایههای مربوط به دو یا چند بیمار مورد آزمایش قرار میگیرند كه تعیین شود كه آیا عفونتهایی كه مطالعه میشوند مربوط به یك استرین و یا استرینهای مختلف بودهاند.
بطور كلی اگر جدایهها بوسیله یك روش تایپینگ ملكولی بصورت متفاوت از یكدیگر كلاسهبندی شوند، ممكن است در حقیقت استرینهای مختلفی باشند و عفونتهای مستقلی را ایجاد كرده باشند. اگر این جدایهها یكسان باشند ممكن است كه بتوان فرض كرد كه یك عفونت متقاطع (Cross -infection) اتفاق افتاده باشد یا اینكه بیماران در مواجهه با یك منبع مشترك، عفونت را كسب كردهاند. اینكه كدام یك از این فرضها قویتر است بستگی دارد به قابلیت تكرار (reproducibility) و قدرت تفكیككنندگی روشهای تایپینگ كه مورد استفاده قرار گرفتهاند. از روشهای تایپینگ همچنین برای كمك به تشخیص مشكلات كلینیكی در رابطه با عفونت مجدد (reinfection) در مقابل عود یا برگشت عفونت (relapse) استفاده میشود و بنابراین برای بررسی توسعه مقاومت ضد قارچی در بین پاتوژنهای قارچی درطول دوره درمان ضدقارچی نیز كمك مینماید. جدایههای متعددی كه متعاقب هم از یك بیمار خاص بدست میآید را میتوان از نظر وابستگی و ارتباط استرین مورد آزمایش قرار دارد. عفونتهای تكرار شونده با استرینهای مختلف یك ارگانیسم میتواند مطرحكننده این باشد كه بیمار مستعد آن عفونت خاص بعلت مواجهههای اختصاصی و یا نقائص مربوط به میزبان است، در حالیكه بهبودی از همان استرین در دفعات متعدد مطرحكننده عفونت عودكننده است كه ممكن است مربوط به یك كانون باقیمانده از قبیل یك كاتتر یا كلیزاسیون پایدار باشد. بعلاوه، تعیین مشخصات انگشتنگاری DNA جدایههای متوالی از بیماران كه تحت درمان ضدقارچی قرار گرفتهاند در نشان دادن پتانسیل توسعه مقاومت ضدقارچی در استرینهایی كه قبلاً حساس بودهاند برای نشان دادن یا آشكاركردن جایگزینی یك استرین مقاومتر بجای یك استرین حساستر تحت فشار آنتیمیكروبیال شدید مفید بوده است. انگشتنگاری DNA پاتوژنهای قارچی با وجود تكنیكهای متنوع و مختلف كاملتر شده است. تقریباً در تمام موارد روشهای انگشتنگاری DNA شامل مقایسههای طرحهایی است كه فرض شدهاند كه ارتباط و نزدیكی ژنتیكی را نشان بدهند. برای مفید بودن بعنوان یك روش تایپینگ اپیدمیولوژیكی، سیستم انگشتنگاری DNA باید به طور مؤثری استرینهای غیر مرتبط ژنتیكی را از هم تشخیص دهد، قادر باشد كه همان استرین را در نمونههای جدا از هم شناسایی كند و ارتباط و نزدیكی یا عدم نزدیكی ژنتیكی را (فاصله ژنتیكی) در بین استرینها یا گونهها مشخص نماید. اگر چه توانایی اكثر روشهای انگشتنگاری DNA برای اندازهگیری فاصله ژنتیكی مشخص نشده، تجزیه و تحلیلهای كیفی الگوهای مختلف DNA در مطالعات مربوط به چند پاتوژن قارچی بیمارستانی مفید بوده است. در بسیاری از مواردی كه تنها تعداد كمی از جدایهها مورد مقایسه قرار گرفتهاند، طرحهای DNA بصورت چشمی در آزمایش قرار گرفته و تخمین كیفی واضحی از نزدیكی یا دوری فاصله ژنتیكی ممكن است بدست آمده باشد. مطالعات اپیدمیولوژیكی بزرگتر دربرگیرنده جدایههای بسیاری است كه بصورت گروههایی از هم جدا شده كه معمولاً به تجزیه و تحلیل كمی بیشتری نیازمند هستند و بكارگیری از یك سیستم كامپیوتری برای هدفدار شدن چنین تحقیقاتی باید از روشی از انگشتنگاری DNA استفاده كرد كه به تجزیه و تحلیل با واسطه كامپیوتر پاسخگو باشد و بصورت یك تخمین معتبر و موثق فاصله ژنتیكی بین استرینها نشان داده شده باشد. در بین متدهای مختلف تنها آنالیز هیبریدیزاسیون ساترن با پروبهای انگشتنگاری بطور متوسط تكرار شونده برای كاندیدا آلبیكنس، كاندیدا تروپیكالیس، كاندیدا گلابراتا، كاندیدا پاراپسیلوزیس و آسپرجیلوس فومیگاتوس نشان داده شده است كه تمام این معیارها را به انجام رساندهاند.
خط مشیهای پیشگیری و كنترل عفونتهای قارچی بیمارستانی میباید امكان مربوط به مخازن عفونت در هر دو مورد عوامل اندوژن و اگزوژن را مد نظر داشته باشند. استفاده از روشهای تایپینگ ملكولی برای انگشتنگاری جدایههای مخمری بیمارستانی در تائید این مطلب كه مخزن عمده اندوژنوس برای این ارگانیسمها باید مجاری دستگاه گوارش در نظر گرفته شود، سودمند و كارساز بوده است. اهمیت كلینیكی كلونیزاسیون دستگاه گوارش و محلهای دیگر بدن توسط مخمرهای غیراز گونههای كاندیدا بطور كامل تحقیق نشده است. بعضی از مطالعات كنترل شده اكنون نشان دادهاند كه كلونیزاسیون قبلی مخاطی توسط گونههای كاندیدا یك فاكتور خطر مستقل برای كاندیدمی میباشد. علاوه بر این حقیقت كه كلونیزاسیون با یك قارچ غالباً مقدمه عفونت است، گواه و مدرك برای یك مخزن اندوژنوس عفونت مخمری بیمارستانی شامل و دربرگیرنده جداسازی استرینهای یكسان بیمار از محلهای آناتومیك متعدد در طول زمان و این حقیقت كه استرینهای كلونیزه شده و ایجاد كننده عفونت معمولاً پروفایل انگشتنگاری DNA یكسانی را به اشتراك نشان میدهند. خط مشیهای مربوط به پیشگیری از عفونتهای قارچی اندوژنوس باید حداقل بر روی روشهایی كه موجب كاهش كلونیزاسیون مخاطی شوند (شامل استفاده كمتر از آنتیبیوتیكهای وسیع الطیف) متمركز گردند. استفاده از عوامل ضدقارچی برای كاهش كلونیزاسیون مخاطی نیز ممكن است موجه باشد، اگر چه مسئله توسعه مقاومت و انتخاب گونههای كمتر پاسخگو ممكن است این روش را محدود سازد.
بصورت روشنی بسیاری از عفونتهای كپكی بیمارستانی بطور اكتسابی از محیط خارجی (اگزوژنوس) بیمار را درگیر میكنند. اگرچه روشهای تایپینگ ملكولی كمتر برای مطالعه عفونتهای بیمارستانی ناشی از كپك بكار رفتهاند، Girardin و همكاران از یك پروب DNA بطور متوسط تكرار شونده برای انگشتنگاری جدایههای آسپرجیلوس فومیگاتوس استفاده كردند. این محققین نشان دادند كه بیماران مبتلا به آسپرجیلوزیس تهاجمی با یك ژنوتیپ واحد عفونی شده بودند و این ژنوتیپ در بین بیماران با یكدیگر اختلاف داشت. بعلاوه آنها همچنین ژنوتیپهای متعددی از آسپرجیلوس فومیگاتوس را در محیط بیمارستانی آشكار كردند و مدارك و شواهدی برای منشأ محیطی یك استرین كه دو بیمار را آلوده كرده بود یافتند. هرچند كه مخزن اولیه برای عفونت مخمری بیمارستانی اندوژنوس است شواهد حمایتكننده برای اكتساب خارجی (اگزوژنوس) این ارگانیسمها هم رو به افزایش است. اكنون دلائل بنیادی برای انتقال گونههای كاندیدا، مالاسزیا و ترایكوسپورون بیژلی به بیماران در معرض خطر زیاد بوسیله تزریقهای (انفوزه) آلوده شده، دستگاههای بیومدیكال یا دستهای مراقبین بهداشتی (پزشكان و پرستاران) وجود دارد. مطالعات مربوط به محیط غیر زنده بیمارستانی مطرح میكنند كه استرینهای كاندیدا ممكن است بر روی سطوح محیطی زنده بمانند و امكان اكتساب بیمارستانی چنین استرینهایی وجود دارد. اپیدمیولوژی مربوط به اكتساب پاتوژنهای قارچی بیمارستانی همانند عفونت اندوژنوس، به كمك روشهای تایپینگ ملكولی برای شناسایی استرینهای مشترك در بین جدایهها از منابع خارجی و بیماران مبتلا روشن شده است.
عفونتهای قارچی مكتسبه از جامعه
عوامل میكوزهای اكتساب شده از جامعه شامل قارچهای دو شكلی كه در حدود مرزهای جغرافیایی خاص وجود دارند و نیز شعاع افزایشیابنده مخمرها و كپكهای فرصتطلب میباشند. علیرغم اختلافات فوقالعاده و عظیم در مشخصههای بیولوژیك و فیزیولوژیك آنها، این ارگانیسمها تماماً از طریق محیط منشأ میگیرند و تاریخچه طبیعی مشابه مشتركی در رابطه با عفونتهای انسانی دارند. اسپور عفونیزایی كه در محیط وجود دارد اعم از اینكه مخمر یا كپك باشد بوسیله استنشاق، بلعیدن یا تلقیح ناشی از تروما وارد بدن میشود و یك عفونت لوكالیزه در ریه، سینوسهای اطراف بینی یا بافتها پدید میآید. گسترش عفونت لوكالیزه یا انتشار به ارگانهای دیگر عمدتاً به اندازه (dose) یا مقدار عامل عفونی، وضعیت ایمنی میزبان و در برخی موارد به خواص اختصاصی ارگانیسم عامل عفونت بستگی دارد. تعدادی از این میكوزها بیماری سخت و مرگآوری بویژه در بیماران ایدزی و یا در وضعیتهای دیگری از اختلالات سیستم ایمنی ایجاد میكنند. بسیاری از متخصصین را عقیده بر این است كه انسیدانس این نوع میكوزها و تنوع عوامل اتیولوژیك آنها در حال افزایش است. متأسفانه فهم ما از جنبههای اكولوژیك و اپیدمیولوژیك این عفونتها محدود است.
قارچهای دوشكلی یا آندمیك
برخلاف عفونتهای بیمارستانی و مكتسبه از طریق جامعه كه بوسیله قارچهای فرصتطلب دیگر پدید میآیند، عفونتهای ایجاد شده از طریق پاتوژنهای دو شكلی و اندمیك نظیر هیستوپلاسما كپسولاتوم، كوكسیدیوئیدس ایمیتیس، بلاستومایسس درماتیتیدیس، پاراكوكسیدیوئیدس برازیلینسیس و پنیسیلیوم مارنفئی در نواحی جغرافیایی ویژهای پدید میآیند. اگر چه این میكوزها افراد دارای ایمنی شایسته و نیز بیماران مبتلا به اختلالات سیستم ایمنی، هر دو را درگیر میكنند ولی عفونتهای شدید و مهلك علیالخصوص هیستوپلاسما كپسولاتوم، كوكسیدیوئیدس ایمیتیس و پنیسیلیوم مارنفئی در بین بیماران ایدزی و گیرندگان پیوند عضو شایعتر است.
هیستوپلاسما كپسولاتوم
هیستوپلاسما كپسولاتوم واریته كپسولاتوم عامل مسبب هیستوپلاسموزیس است و در مناطق و ایالات مركزی آمریكا و در آمریكای لاتین، اندمیك میباشد. عفونت شدید و جدی با این قارچ بصورت بیشتر شایع در بیماران ایدزی و گیرندگان پیوند عضو دیده میشود. هیستوپلاسموز در تقریباً 4% گیرندگان پیوند كلیه و در 2 تا 5 درصد بیماران ایدزی در مناطق اندمیك واقع میشود.
در نواحی اندمیك شهرهای بزرگتر مثل ایندیانا پولیس، كانزاس، ممفیس و ناشویل، انسیدانس هیستوپلاسموز در بین بیماران ایدزی تا 25% هم میرسد. ارگانیسم نوعاً از خاكهای آلوده شده با فضولات ماكیان یا خفاش جدا میشود و تعدادی از اپیدمیها در بین انسانهای مبتلا و غیر مبتلا به HIV یا بهمخوردگی خاك آلوده و با كارهای ساختمانی در داخل یا اطراف بیمارستانها مرتبط بوده است. میزان حملات بالا در بین بیماران ایدزی در طول اپیدمیهای شناخته شده هیستوپلاسموزیس را با عملیات ساختمانی فعال و بهمخوردگی خاك مطرح كردهاند كه بسیاری از موارد بیانگر عفونتهای اكتساب شده جدید خارجی هستند كه مربوط به مواجهه اخیر (تازه) میباشند، نه آنكه دوباره فعال شدن بیماری نهفته باشند. در نواحی غیر اندمیك، موارد جدید هیستوپلاسموزیس به احتمال بیشتر بیانگر فعال شدن مجدد عفونت (راكتیواسیون) است كه در طول اقامت یا هنگام مسافرت به نواحی اندمیك كسب شده است. مطالعات اپیدمیولوژی ملكولی از این فرضیه كه فعال شدن مجدد یك كانون خفته یك راه مشترك و معمولی برای اكتساب هیستوپلاسموزیس در نواحیی است كه در آنها بیماری آندمیك نیست، پشتیبانی میكنند.
كوكسیدیوئیدومایكوزیس
كوكسیدیوئیدومایكوزیس بیماری است كه بوسیله قارچ دو شكلی كوكسیدیوئیدس ایمیتیس ایجاد میشود و در نواحی صحرایی ایالات جنوب غربی آمریكا، شمال مكزیك و آمریكای مركزی اندمیك است. این قارچ در خاك یافت میشود و رشد آن در محیط توسط فضولات خفاش و جوندگان تقویت میشود. مواجهه با آرتروكونیدی عفونتزای قارچ در اواخر تابستان و در فصل پائیز كه شرائط جوی با گرد و غبار همراه میشود، بیشتر است. فصول خشك كه متعاقب آن دورههای با بارندگی سنگین فرا میرسد، با موارد بسیار زیاد عفونت مرتبط بوده است. ابتلاء به كوكسیدیوئیدومایكوزیس اساساً توسط استنشاق آرتروكونیدی قارچی واقع میشود و در نواحی آندمیك میزان عفونت ممكن است به 16 تا 42 درصد و یا بیشتر هم برسد. كوكسیدیوئیدومایكوزیس بعنوان یك بیماری عفونی جدید در نظر گرفته میشود، زیرا بسیاری از افراد بویژه افراد مسن مبتلا به وضعیتهای پزشكی مزمن را كه به سمت مناطق اندمیك حركت كردهاند، درگیر كرده است و همچنین بعلت اینكه تعداد افراد بیشتری كه بعلت عفونت با HIV ایمنوسوپرس شدهاند، در معرض خطر این بیماری قرار میگیرند. شواهدی وجود دارند كه ظهور این بیماری را ثابت میكنند، بعنوان مثال میتوان به افزایش قابل توجه بیماری در دوره زمانی بین 1990تا 1995 در ایالتهای كالیفرنیا و آریزونا اشاره كرد.
بصورت قابلتوجهی،كوكسیدیوئیدومایكوزیس در آریزونا بصورت نامتناسبی افراد مسنتر از 65 سال و نیز افراد مبتلا به عفونت HIV را درگیر كرده است. عفونت با این قارچ تهدید عمدهای برای افراد ایدزی و گیرندگان پیوند ارگانهای جامد است كه در نواحی آندمیك ساكن هستند و یا در هر زمانی از عمر خودشان به این نواحی مسافرت كردهاند. كوكسیدیوئیدومایكوزیس علامتدار در 4/5 درصد گیرندگان پیوند قلب و در 7% گیرندگان پیوند كلیه در آریزونا نشان داده شده است. در یك مطالعات آیندهنگر در توسكان (آریزونا)، كوكسیدیوئیدومایكوزیس علامتدار در 25% بیماران HIV مثبت در طول یك دوره زمانی 41 ماهه پدیدار شد. فاكتورهای خطر برای ایجاد بیماری فعال در بین افراد HIV مثبت كه لنفوسیتهای CD4 آنها كمتر از 250 عدد در میكرولیتر است، تشخیص ایدز و وجود آلرژی به تستهای آنتیژنی پوستی كنترلی است. مسئله مهم اینكه طول مدت زمان باقی ماندن در منطقه آندمیك، حضور یك تاریخچه عفونت قبلی كوكسیدیوئیدومایكوزیس و یك تست مثبت كوكسیدیوئیدال با توسعه بیماری فعال مرتبط نبودهاند، بنابراین اگر چه عفونت اكتساب شده قبلی ممكن است مجدداً فعال شود و بیماری فعال ایجاد نماید، دادههای موجود مطرح میكنند كه بسیاری از موارد كوكسیدیوئیدومایكوزیس در بین افراد HIV مثبت به تازگی كسب شدهاند و مربوط به فعال شدن مجدد عفونت خفته نیستند. پیشگیری از كوكسیدیوئیدومایكوزیس مشكل است، اما درك بهتر ما از اپیدمیولوژی بیماری ممكن است در تلاشهایی كه برای پیشگیری مؤثر این بیماری میشود مفید باشد. در این مورد نكات خاصی كه میباید در نظر گرفته شود این است كه ویژگیها و خصوصیات مربوط به فاكتورهای محیط و میزبان را كه مربوط به اكتساب عفونت است بویژه در بین افراد مسن و جمعیتهایی كه با HIV آلوده شدهاند بصورت مطلوبی بررسی كرد. باید گزارشهای بسیار كاملتر مربوط به موارد بیماری را ترفیع بخشید و سطح آگاهی نسبت به این بیماری را در بین كلینیسینها و عموم مردم افزایش داد و تلاشهایی را كه برای ارزیابی راههای ایمنوپروفیلاكتیك (پیشگیری از راه ایمنسازی) و شیموپروفیلاكتیك میشود در بین افراد در معرض خطر زیادی كه در نواحی آندمیك زندگی میكنند بیشتر توسعه داد. عاقلانه و سنجیده بنظر میرسد كه برای افرادی كه در معرض خطر زیادی قرار دارند ( افراد آلوده شده با HIV، گیرندگان پیوند اعضاء جامد و افراد مسنتر از 65 سال) كه به سمت نواحی آندمیك بیماری حركت میكنند، باید مراقب بود كه در مشاغل و پیشههائی كه دربرگیرنده برخورد و مواجهه مستقیم با خاك و گرد و غبار است درگیر نشوند، زیرا نشان داده شده است كه این فعالیتها با ایجاد و گسترش بیماری كوكسیدیوئیدومایكوزیس مرتبط بوده است.
بلاستومایسس درماتیتیدیس و پاراكوكسیدیوئیدس برازیلینسیس
اگر چه انتشار جغرافیایی بلاستومایسس درماتیتیدیس و پاراكوكسیدیوئیدس برازیلینسیس به خوبی مطالعه شده است، عفونتهای مربوط به این دو ارگانیسم نسبتاً غیرشایع هستند و در مورد میزان بروز آنها كمتر میدانیم. هر دو این بیماری ممكن است بوسیله تماس با خاك و مواد آلی ایجاد شوند. این كه آیا عفونت با این دو قارچ در بین افراد مستعد از نظر ایمنی بیشتر دیده میشوند به روشنی مشخص نیست.
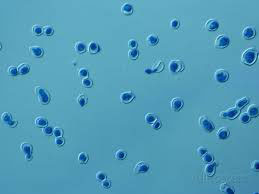
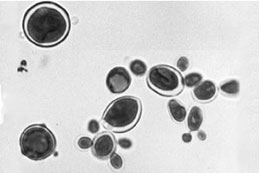
تصویر بالا مربوط به بلاستومایسس درماتیتیدیس و تصویر پائین مربوط به پاراكوكسیدیوئیدس برازیلینسیس میباشد.
پنی سیلیوم مارنفئی
پنی سیلیوم مارنفئی قارچ دوشكلی است كه به تازگی شناخته شده و در آسیای جنوب شرقی بصورت آندمیك وجود دارد. عفونتهای مربوط به این قارچ در افراد سالم و نیز در افراد مستعد از نظر ایمنی دیده میشود، اكثر موارد در بین افراد آلوده با HIV دیده میشود. تمام عفونتهای شناخته شده در بیمارانی دیده میشود كه در آسیای جنوب شرقی زندگی كرده و یا به آن مناطق مسافرت كرده باشند. در شمال تایلند عفونت با این قارچ بصورت سومین عامل شایع عفونتهای فرصتطلب (بعد از توبركولوز و كریپتوكوكوزیس) در بین افراد آلوده شده با HIV مطرح است.
مخزن محیطی برای ارگانیسم دو گونه موش و محل زندگی (كانال و مجاری لانهها) آنها است. با اینكه قارچ عامل بیماری به نظر نمیرسد كه در بخشهای دیگری از جهان وجود داشته باشد، مسافرتهای رو به افزایش بین المللی آشكارشدن بیماری را در فراتر از نواحی آندمیك بیماری خاطر نشان ساخته است.
پاتوژنهای فرصتطلب
همانطور كه قبلاً ذكر شد، طیف پاتوژنهای قارچی فرصتطلب تقریباً نامحدود است. برحسب درجه و میزان ایمنوسوپرسیون كه یا بعلت مداخلات پزشكی و یا بدلیل ثانوی به عفونت HIV عارض میشود، عملاً هر نوع قارچی كه در محیط وجود دارد ممكن است عفونت لوكالیزه یا مهاجمی در مواجهه با میزبان مناسب ایجاد نماید. اثربخشی نسبی عوامل آنتیباكتریال برای كنترل و پیشگیری از عفونتهای مهلك باكتریایی در افراد مستعد از نظر ایمنی راه را برای افزایش عفونت با قارچهای فرصتطلب مهیا كرده است. متأسفانه بدلیل اینكه چنین عفونتهایی بعنوان بیماریهای قابل گزارش در نظر گرفته نمیشوند، انسیدانس حقیقی آنها ناشناخته است و درك ما از اپیدمیولوژی این بیماریها در بهترین حالت در حداقل میزان خود است. فاكتورهای خطر برای این دسته از عفونتهای قارچی فرصتطلب شامل موارد بسیاری است كه در جدول شماره 1 لیست شده است. در حقیقت، در بسیاری از موارد تفاوت بین عفونت قارچی فرصتطلب بیمارستانی با عفونتهای قارچی فرصتطلب اكتساب شده از جامعه به راحتی میسر نیست.
جدول شماره 1- فاكتورهای خطر برای فونژمی در بیماران بستری
| فاكتور خطر | نقش احتمالی فاكتور خطر در ایجاد عفونت قارچی |
| عوامل آنتی میكروبیال |
تحریك و تشویق كلونیزاسیون قارچی، فراهم كردن دسترسی عروقی |
| كورتیكوستروئید | ایمیونوسوپرسیون |
| شیموتراپی | ایمیونوسوپرسیون |
| نئوپلاسمها | ایمیونوسوپرسیون |
| كلونیزاسیون قبلی | جابجائی و انتقال از طریق مخاطها |
| كاربرد كاتتر | دسترسی مستقیم عروقی، انتقال آلودگی |
| تغذیه از طریق رگ | دسترسی مستقیم عروقی، آلودگی مایع انفوزه |
| نوتروپنی (تعداد كمتر از 500 در میلی متر مكعب) | ایمیونوسوپرسیون |
| جراحی یا سوختگیها | راه سرایت عفونت، دسترسی مستقیم عروقی |
| حمایت تنفسی (دستگاه بنت) | راه سرایت عفونت |
| بستری در بخش مراقبت ویژه یا بخشهای بیمارستانی | مواجهه با عوامل پاتوژن، مواجهه با ریسك فاكتورهای مختلف |
| همودیالیز | راه سرایت عفونت، ایمیونوسوپرسیون |
| سوء تغذیه | ایمیونوسوپرسیون |
بطور فزایندهای، اكنون بیمارانی كه دارای اختلالات ایمنی بنیادی هستند بعوض بیمارستان در خانه نگهداری و مراقبت میشوند و بنابراین ممكن است با قارچهای فرصتطلبی مواجه شوند كه ممكن است در محیط بیمارستانی موجود نباشند. در بین پاتوژنهای قارچی فرصتطلب اكتسابی از جامعه، شاید مهمترین و اصولاً شایعترین عامل عفونت جدی با كریپتوكوكوس نئوفرمنس باشد. این بیماری قبل از آنكه HIV اپیدمیك شود، بصورت بیماری نادری مطرح بوده است. كریپتوكوكوزیس یكی از شایعترین عفونتهای مهلك در بیماران ایدزی است و امروزه شایعترین عامل مننژیت در بسیاری از بیمارستانهایی است كه در آنها از بیماران ایدزی مراقبت میشود. اگرچه تخمینهای دقیق از انسیدانس بیماری كریپتوكوكال در دسترس نیست، اما تخمین زده میشود كه انسیدانس بیماری از سال 1980 تا 1989 حداقل به میزان 5 برابر افزایش یافته است. این افزایش همراه با شیفت بیماری از گروههای سنی بالاتر به سمت گروههای سنی است كه بیشتر تحتتأثیر ایدز قرار گرفتهاند. دادههای جدید از CDC مطرح میكنند كه در نواحی شهری كه در آن افراد آلوده با HIV تراكم دارند، انسیدانس بیماری ممكن است به میزان 5 مورد به ازای هر 100/000 نفر جمعیت باشد. با معرفی درمان بسیار فعال ضد ویروسی (HAART )، فراوانی عفونت كریپتوكوكال در بین افراد HIV مثبت كاهش یافته است. با اینحال این قارچ یك پاتوژن مهم در این دسته از بیماران است. كریپتوكوكوس نئوفرمنس دارای 2 واریته بنامهای نئوفرمنس و گتی است كه دارای جایگاههای اكولوژیك متفاوتی هستند. كریپتوكوكوس نئوفرمنس واریته نئوفرمنس در همه جای جهان یافت میشود و بصورت فراوانتر از خاك آلوده به فضولات پرندگان جدا میشود. كریپتوكوكوس نئوفرمنس واریته گتی به نواحی گرمسیری و تحتحاره محدود میشود و تنها جایگاه اكولوژیك آن درختهای اكالیپتوس است. طبیعت ذره عفونیزا در مورد هر یك از واریانت ها معلوم نیست، اما فرض بر این است كه عفونت بوسیله استنشاق اشكال عفونیزا از طریق محیط حاصل میشود. مطالعات اپیدمیولوژیك جدید كه از چندین روش تایپینگ ملكولی استفاده كردهاند، بینشهای جدیدی درمورد اپیدمیولوژی بیماری كریپتوكوكال پدید آوردهاند. این مطالعات مطرح كردهاند كه بیماری عود كننده كریپتوكوكال در افراد مبتلا به ایدز نتیجه باقی ماندن استرین آلودهكننده اولیه است. بعلاوه مقایسه جدایههای محیطی و كلینیكی در شهر نیویورك مطرحكننده امكان منبع محیطی برای عفونتهای انسانی است.
نتیجهگیری
واضح است كه هر دو نوع عفونتهای قارچی بیمارستانی و عفونتهای قارچی كسب شده از جامعه روز به روز بیشتر و چشمگیرتر میشوند. تعداد افرادی كه در معرض خطر برای ابتلاء به عفونتهای قارچی قرار میگیرند، در مقایسه با سالهای قبل در حال افزایش است. در نتیجه عفونتهای مربوط به قارچهای شایع و قارچهایی كه قبلاً بیماریزایی مبهمی داشته و یا غیرمعمول بودهاند، امروزه هم در محیط بیمارستانی و هم در جامعه با فراوانی بیشتری دیده میشوند. متأسفانه فهم ما از اپیدمیولوژی عفونتهای قارچی كاملاً ابتدایی و ناچیز است و روشهای تشخیص ناكافی از یك طرف و فقدان اجبار و الزام برای گزارش بیماریهای قارچی به مراكز بهداشتی و دیگر مراكز و مراجع مربوط، بصورت موانع مهمی بر سر راه درك و فهم بهتر ما از اپیدمیولوژی عفونتهای قارچی عمل میكنند. تلاشهای متمركز CDC و گروههای دیگر برای مطالعه عفونتهای قارچی بیمارستانی درك ما را از این دسته از عفونتهای بیمارستانی افزایش دادهاند.
امروزه این گونه مطالعات با استفاده از روشهای تایپینگ ملكولی بهتر یاری شدهاند. تغییر جهت از سمت مراقبتهای بهداشتی در محیط بیمارستانی به سمت مكانها و محیطهای خارج بیمارستانی تأكید بیشتری روی نیاز به درك اپیدمیولوژی میكوزهای اكتساب شده از جامعه مینمایند. ادامه تحقیقات اپیدمیولوژیك و آزمایشگاهی برای آنكه طیف رو به افزایش پاتوژنهای قارچی فرصتطلب و آندمیك بهتر مشخص شوند، ضرورت دارد. این امر اجازه میدهد كه استراتژیهای پیشگیری، درمانی وتشخیصی در آینده بهبود یابند.
منبع
ترجمه كامل (با اندكی دخل و تصرف) فصل اول از كتاب كلینیكال میكولوژی تألیف الیاس ج آناایسی، میخائیل ر مك گینیس و میخائیل آ پفالر چاپ اول (2003).
