اکتینومایکوزیس
مقدمه
اکتینومایکوزیس یک آلودگی باکتریایی گرانولوماتوزی و چرکدار، مزمن و با پیشرفت آرام میباشد. محل درگیری متورم و همراه با چرک، آبسه، فیبروز بافتی و ترشحات سینوسی میباشد. عفونتهای سر و گردنی بسیار معمولتر است، هر چند که نواحی دیگر بدن نیز امکان ابتلا را دارند و بیماری منتشره و اسکلتی غضروفی هم به ندرت ممکن است مشاهده شود. این بیماری حدود 150 سال پیش تشخیص داده شد و هنوز هم بسیار ناشناخته مانده است. بیماری انتشار جهانی دارد و بصورت تک گیر در سراسر دنیا از جمله ایران گزارش شده است. تظاهرات متفاوت بیماری باعث ميشود كه با بدخیمیها اشتباه شوند که بعلت عدم تشخیص مناسب بیماری میباشد.
اتیولوژی
اکتینومایکوزیس غالباً ناشی از اکتینومایسس اسرائیلی است و به نسبت کمتر توسط اکتینومایسس نیوزلندی، اکتینومایسس ادونتولیتکوس، اکتینومایسس میری و اکتینومایسس گرنسسری (قبلاً به نام اکتینومایسس سرووار شناخته میشد) ایجاد میگردد. عوامل پروپیونی باکتریوم پروپیونوم (آراکنیا پروپینیکا) و بیفیدیو باکتریوم انتیوم (اکتینومایسس اریکسونی) غالباً با اشکال غیر قابل تشخیص بیماری در ارتباط هستند. این ارگانیسمها گرم مثبت، رشتهای منشعب، بدون اسپور، غیر اسیدفست و غیرهوازی هستند. اکتینومایسسها باکتریهای سخت رشد بوده که نیازمند محیطهای کشت غنی هستند که 6 تا 10 درصد دی اکسید کربن به رشد آنها کمک میکند و کلنیهای شبیه به دندان آسیا (molar tooth) در محیطهای جامد و خرده نان (bread crumb)در محیطهای مایع را تشکیل میدهند. اکثر آلودگیهای اکتینو مایکوتیک چند میکروبه (پلی میکروبیال) بوده و شامل دیگر باکتریهای هوازی و غیرهوازی میباشد. اکتینومیسس اسرائیلی بطور کامنسال در دهان، اطراف لثه، دندانها، کریپت لوزه، دستگاه تنفس، پرزهای روده و ناحیه آپاندیس انسان و حیوانات وجود دارد. این ارگانیسم آندوژن بوده و تحت شرایط خاص از جمله کاهش مقاومت بدن و جراحتدار شدن بافتها قادر به ایجاد بیماری است. در لوزههای غیرعفونی نیز گاهی دانههای مربوط به این ارگانیسم موجود میباشد. اکتینومیسس نیوزلندی و چند گونه دیگر همانند اکتینومیسس اسرائیلی ساکن طبیعی حفره دهان و احتمالاً دستگاه گوارش و واژن انسان ذکر شدهاند
اپیدمیولوژی
خانواده اکتینومایسس اکثراً فلور نرمال دهان، دستگاه گوارش و دستگاه تناسلی زنان میباشند. هیچ مخزن محیطی برای آنها یافت نشده و انتقال شخص به شخص نیز منجر به اکتینومایکوزیس نمیشود. هر چند که انتقال شخص به شخص در اکتینومایستهاي گونههای پاتوژنیک میتواند رخ بدهد. آلودگی در همه سنین مشاهده ميشود، اگرچه بیماری به ندرت در بچهها و یا بیماران با سن بیشتر از 60 سال مشاهده میشود، ولي اکثر بیماران در سن میانسالی میباشند. نسبت آلودگی زن به مرد 1 به 3 میباشد که ناشی از بهداشت بد دهان و بالا بودن نسبت ضربات دهانی در مردان میباشد. در طول سال 1970 یکی از هر 300.000 مورد در ناحیه آمریکای شمالی مشاهده شده است؛ هر چند که بهداشت مناسب دندان و استفاده از درمانهای آنتیبیوتیکی منجر به بهبود و کاهش این شیوع شده است. شیوع سالانه در آمریکا 100> میباشد، اما از آنجا که این ارگانیسم سخت رشد میباشد و تشخیص آن دشوار است احتمال دارد شیوع بیماری بالاتر باشد.
بیماریزایی و پاتولوژی
گونههای اکتینومایسس پاتوژنیسیته پائینی داشته و بیماریزایی نیازمند شکسته شدن سطح موکوسی میباشد. بیماری معمولاً در بیماران با سیستم ایمنی سالم رخ میدهد، اما ممکن است اشخاصی با کاهش سطح دفاعی بدن را نیز مبتلا کند. بیماری دهان و فکی- صورتی معمولاً در اثر پوسیدگی، کشیدن دندان، التهاب لثه، ضربه به لثه، آلودگی در محل جوانه دندانهای ثانویه و لوزه مزمن ميباشد و در اثر آماس گوش یا اوتیت، دیابت ملیتوس، تضعیف سیستم ایمنی، سوءتغذیه و یا آسیبهای بافتی ناشی از جراحی هم ايجاد ميشود. آلودگیهای ریوی معمولاً به دنبال آسپیراسیون اروفارینژال یا معده- رودهای (گاستروانتستینال) رخ میدهد. آلودگیهای گاستروانتستینال معمولاً به دنبال جراحیها، آپانديسیت، ضربه یا جسم خارجی رخ میدهد. استفاده از IUDها با ایجاد اکتینومایکوزیسس در دستگاه تناسلی زنان در ارتباط است. دیگر ریسک فاکتورهای بیماری استفاده از استروئیدها، داروهای تضعیف کننده سیستم ایمنی و همچنین آلودگی HIV میباشد. علاوه بر این میکروارگانیسمها، زخمهای اکتینومایکوتیک حاوی باکتریهای دیگری نیز میباشد. از مهمترین این باکتریها میتوان به: Peptostreptococcus Bacteroides،Actinobacillus actinomycetemcomitans ،Prevotella Fusobacterium ، Staphylococcus spp، Enterobacteriaceae و Streptococcus spp اشاره کرد. این ارگانیسمها پاتوژنسیته کمتری نسبت به اکتینومایستها دارند و ممکن است به وسیله ممانعت از سیستم دفاعی و کاهش فشار اکسیژن ناحیه در انتشار بیماری نقش داشته باشند و بعد از ثبات میکروارگانیسم در ناحیه ممکن است به بافتهای اطراف انتشار پیدا کند. آلودگی بافتهای اطراف اغلب با ترشحات سینوسی و فیبروز بخصوص در آلودگیهای لگنی شکمی رخ میدهد. دیوارههای فیبروتیک به صورت یک توده سخت قبل از ترشح چرک که اصطلاحاً به آن (wooden) گفته میشود و ممکن است با نئوپلاسم اشتباه شود، ديده ميشود. انتشار خونی نیز میتواند رخ بدهد، ولی بسیار نادر میباشد.
آلودگی معمولاً بدون توجه به موانع آناتومیکی مثل لایههای پوششی و مجاری لنفاوی انتشار پیدا میکند. اکتینومایسسها بصورت میکروسکوپی و خوشهای، ماکروسکوپی به صورت رشتههای درهم که به وسیله نوتروفیلها احاطه شده است، رشد پیدا میکنند. پلاسماسلها و سلولهای چند هستهای غالباً در زخمها یافت میشوند و بیشتر بهصورت ماکروفاژهای دارای سیتوپلاسم کفآلود در مرکز ناحیه چرکی یافت میشوند. این خوشهها یا دانهها بی رنگ تا زرد رنگ بوده و از طریق سینوسها تراوش پیدا میکنند که به آنها گرانولهای سولفور (Sulfar granules) گفته میشود. این گرانولها (2-1 میلیمتر قطر داشته) در اثر تجمع ارگانیسمها و کلسیم فسفات ایجاد میشوند. از یک تا 6 گرانول در هر ناحیه میتواند وجود داشته باشد و بیشتر از 50 ناحیه در هر زخم وجود دارد. ارگانیسمهای دیگر (نوکاردیا، استرپتومایسس استافیلوکوک در بوتریومایکوزیسس) میتوانند شبیه به گرانولهای سولفور اکتینومایسسها تجمع و گرد شوند، بنابراین لازم است رنگآمیزیهای اختصاصی و ایمنوفلورسانس برای اکتینومایسسها صورت بپذیرد.
تظاهرات بالینی
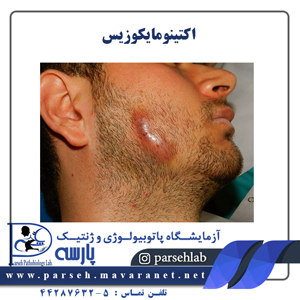
سر و گردنی(Cervicofacial)
معمولترین و شایعترین آلودگی اکتینومایکوزیس میباشد و غالباً منشأ عوارض دندانی و باز شدن تورمهای بافت نرم دردناک یا با درد کم که مزمن یا تحت حاد است، میباشد. هنگامی که استاف ارئوس و استرپتوکوک بتا همولیتیک هم وجود داشته باشند، آبسههای دردناک حاد یا سلولیت ممکن است بصورت تظاهرات اولیه ایجاد شود. فرم مزمن آلودگی دارای خصوصیاتي همچون درد کم و سینوسهای مترشحه چرک که ممکن است حاوی گرانولهای سولفور در بیش از 25 درصد موارد باشد، است. عفونت ممکن است به رگها، زبان، سینوسها، گوشها، چشم، غدد بزاقی، حلق، عضلات جویدنی، تیروئید، حنجره، نای و یا قفسه سینه گسترش پیدا کند. گرفتاری استخوان ممکن است در اثر نفوذ از بافتهای نرم مجاور باشد كه منجر به پریواستیتیس یا استئومیلیت می شود. رادیوگرافی، ضایعات دیررس استخوانی را نشان میدهد. در بیماران معالجه نشده عفونت گاهی به سمت سطوح فوقانی کشیده میشود و ممکن است استخوانهای جمجمه را نیز فرا گیرد و یا بطرف پایینتر پیشرفت نماید و قفسه صدری را مبتلا سازد. تشخیصهای افتراقی شامل توبرکلوزیس (سل غدد لنفاویscrofula )، آلودگیهای قارچی، نوکاردیوزیس، نئوپلاسم میباشد.
قفسه صدری(Thoracic)
اکتینومیکوزیس قفسه صدری اغلب در اثر استنشاق ارگانیسم که در ترشحات دهان وجود دارد، ایجاد ميشود. گاه نیز در اثر دامنهدار شدن ضایعات اولیه، ریهها نیز گرفتار میشوند. عفونت ریوی شبیه به سایر بیماریهای تحت حاد ریه است. آلودگی بصورت مزمن و به آرامی پارانشیم ریه و فضای پلوری را درگیر میکند و 15 تا 30 درصد موارد اکتینومایکوزیس را شامل میشود. آلودگی غالباً به پرده جنب و دیواره قفسه سینه انتشار پیدا کرده، با فیستولهای احتمالی و ترشح گرانولهای سولفور همراه است. شکایات بیماران دچار اکتینومایکوزیس قفسه صدری به صورت غیراختصاصی است و غالباً درد قفسه سینه و سرفههای مداوم تاریخچهای از بیماریهای زمینهای ریوی در بیماران معمولی است و بیماران به ندرت دچار عفونت اولیه میشوند. بیماری ممكن است با توبرکلوزیس خصوصاً در مواقع وجود کاویته و بلاستومایکوزیس، نوکاردیوزیس، کریپتوکوکوزیس، لنفوما و پنومونی اشتباه شود.
شکمی (Abdominal)
این شکل از بیماری معمولاً مزمن، ناحیهای و دارای التهاب است که غالباً بعد از چند هفته، ماه، یا سال – بعد از شکستن موکوس گاستروانتستینال بوسیله جراحی برای آپانديسیتهای حاد، برای جراحیهای ضروری بر روی مجاری رودهای و بعد از ضربه اکتینومایکوزیس شکمی – ممکن است فاقد هرگونه فاکتور پیشبینی کننده درستی باشد. آلودگی به آرامی به بافتهای همجوار بخصوص کبد و طحال و دیوار شکم انتشار پیدا میکند. سینوسهای ترشح کننده ممکن است وجود داشته باشد و شامل ناحیه پرهآنال میباشد که شبیه به بیماری کرون یا توبرکلوزیس است. علائم و نشانهها غالباً غیر اختصاصی بوده و شامل تب، اسهال یا یبوست، کاهش وزن، تهوع و استفراغ میباشد.
لگنی (Pelvic)
این آلودگی غالباً در خانمها که یک دوره زمانی طولانی و غالباً برای بیشتر از 2 سال از IUD استفاده ميكنند، مشاهده میشود. اکتینومایکوزیس لگنی ممکن است همچنین در اثر گسترش آلودگی از نواحی شکمی باشد. تظاهرات بیماری ممکن است رنجی از ترشحات مزمن واژینال تا بیماری التهاب لگنی با آبسه لولههای تخمدان یا تودههای شبه توموری باشد. بیماران غالباً با خونریزی تا ترشحات واژینال غیرطبیعی، دردهای لگنی- شکمی، تب، افزایش خونریزی قاعدگی و کاهش وزن همراه میباشند.
سیستم عصبی مرکزی (Central Nervous System)
آلودگی CNS بسیار نادر است و معمولاً تظاهرات بصورت تک یا چند آبسه مغزی میباشد که بصورت زخمهای پیشرونده با دیواره نازک وجود دارد که در سی تی اسکن به صورت ندولار و یا نامنظم مشاهده میشود. سردرد و علائم عصبی کانونی از علائم اصلی بیماری هستند. اکثریت آلودگیهای اکتینومایکوزیس CNSاز طریق انتشار از طریق خون از نواحی دور ایجاد میشود. هر چند که انتشار مستقیم فکی- صورتی به خوبی تشخیص داده میشود. مننژیت ناشی از اکتینومایسس معمولاً مزمن و پلی سیتوزیس و لنفوسیتیک است، بنابراین ممکن است با مننژیتهای توبرکلوزیس اشتباهاً تشخیص داده شود.
تلفن های ما: 5-44287632
تشخیص
مطالعات پاتولوژیکال و میکروبیولوژیکال مناسب برای تشخیص ضروری است. نمونه مناسب ارسالی به آزمایشگاه چرک است و از بافت و گرانول سولفور و سواب باید اجتناب شود.نمونه باید سریع به آزمایشگاه منتقل و در محیطهای بیهوازی کشت داده شود. توصیه میشود قبل از نمونهگیری از مصرف داروي ضد میکروبی خودداري شود. کشت بیهوازی لازم است و ارگانیسمهای غیر اسیدفست، گرم مثبت با رشتههای منشعب در نمونههای چرک و بافت از خصوصیات تشخیصی میباشد. وجود گرانولهای سولفور و حضور ارگانیسمهای گرم مثبت بسیار کمک کننده است. در برشهای بافتی رنگ شده با H&E گرانولهای سولفور گرد یا بیضی بازوفیلیک با آرایش اشعهای انتهای ائوزینوفیلیک (clubs) ديده ميشود، هر چند که گونههای اکتینومایسس به فراوانی در برشهای رنگ شده با H&Eمشاهده میشود، ولی با رنگهای اختصاصی مثل GMS وBrown-Benn برشهای بیوپسی از سطوح مختلف بافت منجر به تشخیص بهتر پاتولوژی میشود. گرانولها از ساختمانهای شبیه مانند ارگانیسمهای نوکاردیا، مونوسپوریوم، سفالوسپوریوم، استافیلوکوک (بوتریومایکوزیس) و دیگر اکتینومایسسها و آراکنیا باید تمايز داده شوند. براي افتراق از سایر ارگانیسمهای گرم مثبت بیهوازی از رشد کند، کاتالاز منفی بودن (بجز A.viscosus) و کروماتوگرافی گاز مایع و همچنین آزمایش ایموفلورسانس و فلورسانت آنتی بادی مستقیم هم میتوان استفاده کرد، اما در اکثر آزمایشگاههای میکروبیولوژی در دسترس نمیباشد. قابل تأمل است که استفاده از PCR به وسیله تقویت ژن 16S rRNA توانایی تشخیص را افزایش میدهد. مطالعه تصویربرداری شبیه به رادیولوژی، سی تی اسکن، و MRI خیلی برای تشخیص اختصاصی نیستند، اما در تشخیص مناسب اندازه و وسعت آلودگی مفید میباشند.
تشخيص افتراقی
اکتینومیکوزیس را با همه علائم کلینیکی و اشکال مختلف بیماری باید از نئوپلاسم، سارکوئیدوز، تب تیفوئید، گرانولومای دندانی، توبرکولوزیس، آبسههای استافیلوکوکی و بیماریهای قارچی عمقی تشخیص داد.
درمان
استفاده از آنتیبیوتیکهای وسیعالطیف پیشآگهی بیماری را در همه اشکال تقویت میبخشد. اخیراً سرعت درمان بسیار بالا رفته و مرگ یا هيچ گونه تغییر ظاهری وجود ندارد. پنی سیلین Gداروی انتخابی جهت درمان آلودگیهای ناشی از هرگونه اکتینومایسس است که به صورت دوز بالا و با دوره درمانی طولانی مدت تجويز میشود؛ زيرا آلودگی تمایل به عود مجدد دارد. در اکثر آلودگیهای عمقی باید تزريق پنیسیلین G درون رگی 20-10 میلیون واحد در روز به مدت 2 تا 6 هفته انجام شده و سپس از phenoxypenicillin در دوزهای 2 تا 4 گرم در روز از طریق خوراکی استفاده شود. مقاومت اکتسابی به پنیسیلین G به وسیله اکتینومایسس در درمانهای بلند مدت نادر است. در اینگونه موارد ترکیباتی از پنیسیلین (برای مثال آموکسی سیلین، پیپراسیلین) و ممانعتکنندگان بتالاکتام (برای مثالClavulanate, tazobactam) پیشنهاد میشود. تست حساسیت به آنتیبیوتیک در invitro برای اکتینومایسسها بسیار دشوار است و نتایج ممکن است پیشبینی کننده فعالیت در invivoنباشد.
نتیجهگیری
بیماری مزمن، نادر و ناشی از گروهی از باکتریهای گرم مثبت بیهوازی است که در دهان، کلون و دستگاه ادراری تناسلی کلونیزاسیون میدهد. شایعترین محل آلودگی در فک و صورت است و سپس لگن، شکم و قفسه صدری درگیر میشوند. از آنجایی که اکتینومایکوزیس شبیه به بیماریهای دیگری است و علائم و تظاهرات کلینیکی بسیار گستردهای دارد، آگاهی از علائم مختلف بیماری ضروری است.
سایر مقالات آزمایشگاه پزشکی در غرب تهران :
با تشکر مدیریت سایت آزمایشگاه پارسه
منبع
•1. Smego RA Jr, Foglia G. Actinomycosis. Clin Infect Dis 1998;26:1255-1261
•2. Hall V, Talbot PR, Stubbs SL, et al. Identification of clinical isolates ofactinomyces species by amplified 16S ribosomal DNA restriction analysis. J Clin Microbiol 2001;39:3555-3562.
•3. Lippes J. Pelvic actinomycosis: a review and preliminary look at prevalence. Am J Obstet Gynecol 1999;180:265-269.
•4. Clarridge JE III, Zhang Q. Genotypic diversity of clinical actinomyces species: phenotype, source, and disease correlation among genospecies. J Clin Microbiol 2002;40:3442-3448.
•5. Oostman O, Smego RA. Cervicofacial actinomycosis: diagnosis and management. Curr Infect Dis Rep 2005;7:170-174.
•6. Pulverer G, Schutt-Gerowitt H, Schaal KP. Human cervicofacial actinomycoses: microbiological data for 1997 cases. Clin Infect Dis 2003;;497-37,490.
•7. Curi MM, Dib LL, Kowalski LP, et al. Opportunistic actinomycosis in osteoradionecrosis of the jaws in patients affected by head and neckcancer: incidence and clinical significance. Oral Oncol 2000;36:299.
•8. Chouabe S, Perdu D, Deslee G, et al. Endobronchial actinomycosis associated with foreign body: four cases and a review of the literature.Chest 2002;121:2069-2072.
•9. Mabeza GF,Macfarlane J. Pulmonary actinomycosis. Eur Respir J 2003;21,551-545
•10. de Montpreville VT, Nashashibi N, Dulmet EM. Actinomycosis andother bronchopulmonary infections with bacterial granules. Ann DiagnPathol 1999;3:67-74.
•11. Fife TD, Finegold SM, Grennan T. Pericardial actinomycosis: case report and review. Rev Infect Dis 1991;13:120-126.
•12. Hsieh MJ, Liu HP, Chang JP, et al. Thoracic actinomycosis. Chest 1993;104:366-370.
•13. Kim TS, Han J, KohWJ, et al. Thoracic actinomycosis: CT features with histopathologic correlation. AJR Am J Roentgenol 2006;186:225-231.
•14. Cintron JR, Del Pino A, Duarte B, et al. Abdominal actinomycosis. Dis Colon Rectum 1996;39:105-108.
•15. Wagenlehner FM, Mohren B, Naber KG, et al. Abdominal actinomycosis. Clin Microbiol Infect 2003;9:881-885.
•16. Cayley J, Fotherby K, Guillebaud J, et al. Recommendations for clinical practice: actinomyces like organisms and intrauterine contraceptives.The Clinical and Scientific Committee. Br J Fam Plann 1998;23:137- 138.
•17. Taga S. Diagnosis and therapy of pelvic actinomycosis. J Obstet Gynaecol Res 2007;33:882-885.
•18. Goldberg MH. Diagnosis and treatment of cervicofacial actinomycosis.Oral Maxillofac Surg Clin North Am 2003;15:51-58.
•19. Smego RA Jr. Actinomycosis of the central nervous system. Rev Infect Dis 1987;9:855-865.
•20. Choi J, Koh WJ, Kim TS, et al. Optimal duration of IV and oral antibiotics in the treatment of thoracic actinomycosis. Chest 2005;128:2211-2217.
•21. Hamid D, Baldauf JJ, Cuenin C, et al. Treatment strategy for pelvic actinomycosis: case report and review of the literature. Eur J Obstet Gynecol Reprod Biol 2000;89:197-200.
•22. Sudhakar SS, Ross JJ. Short-term treatment of actinomycosis: two cases and a review. Clin Infect Dis 2004;38:444-447.
•23. Trutnovsky G, Tamussino K, Reich O. Short-term antibiotic treatment of pelvic actinomycosis. Int J Gynaecol Obstet 2008;101:203-204.
•24. Brook I. Beta-lactamase-producing bacteria and their role in infection. Rev Med Microbiol 2005;16:91-99.
•25. Smith AJ, Hall V, Thakker B, et al. Antimicrobial susceptibility testing of actinomyces species with 12 antimicrobial agents. J Antimicrob Chemother 2005;56:407-409.
